| . |
|
||||||
|
|
| . |
|
||||||
Aperçu |
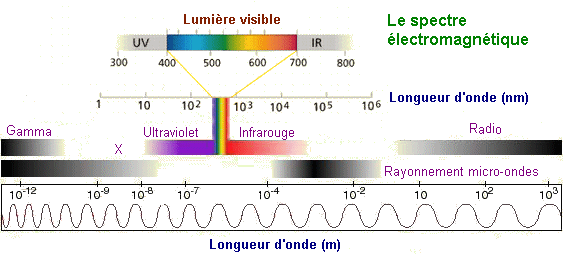
Le mot spectre
revêt en physique plusieurs sens. Employé dans son acception
la plus large, il désigne un ensemble de radiations monochromatiques
d'un type particulier. Ainsi, dans le contexte de l'étude du rayonnement
électromagnétique. On pourra alors parler de spectre électromagnétique
pour désigner toute l'étendue de la gamme de rayonnements
électromagnétiques possibles. Cet ensemble étant couramment
divisé en plusieurs parties ou domaines. Ces domaines vont du rayonnement
gamma, défini par des énergies et des fréquences
très élevées (soit par des longueurs
d'ondes très courtes), au rayonnement radio,
qui correspond à des énergies transportées par chacun
de ses photons très faibles. La lumière
visible, encadrée par le rayonnement ultraviolet (UV) et l'infrarouge
(IR) correspondant pour sa part à un domaine intermédiaire
du spectre.
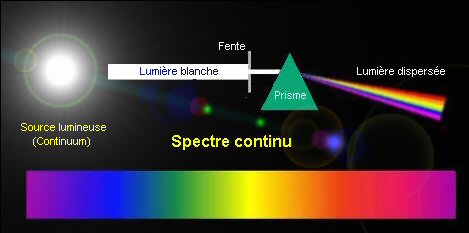
 Le mot spectre sert plus spécialement à désigner la distribution d'une caractéristique telle que l'intensité d'un rayonnement (ou d'une onde quelconque), en fonction de son énergie (ou d'une grandeur qui en dépend comme la fréquence ou la longueur d'onde). On désigne ainsi sous le nom de spectre lumineux la répartition de l'intensité d'une lumière en fonction de la longueur d'onde (ou de la fréquence) des rayonnements qu'elle contient. D'un point de vue plus concret, cela revient à définir un spectre comme l'apparence de la lumière émise par un corps lorsqu'elle est dispersée par un prisme (ou un réseau de diffraction). On reconnaîtra alors trois familles principales de spectres : les spectres continus, où les différentes couleurs observées forment un continuum; les spectres de raies, qui sont eux-mêmes de deux sortes : les spectres en absorption, où certaines radiations (signalées dans le dispositif expérimental par des raies sombres) sont absentes ou très atténuées, et les spectres en émission où, au contraire, certaines radiations (signalées dans le dispositif expérimental par des raies brillantes) sont plus intenses. L'explication des particularités des spectres se trouve dans le caractère quantique des atomes, et plus spécialement de leur enveloppe électronique.
|
|||||||||||||||
Mise en ordre |
Les
spectres continus
Les corps solides
et les gaz très comprimés portés à haute température
(par exemple, un fer chauffé au rouge, ou les parties profondes
de la photosphère des étoiles)
sont à l'origine d'un rayonnement continu, que l'on appelle rayonnement
thermique ou rayonnement de corps noir. Ces
caractéristiques sont indépendantes de la composition chimique
de la source, et sont seulement fonction de sa température, autrement
dit des énergies impliquées. Plus un corps lumineux est chaud,
et plus son spectre continu contient de rayonnements bleus (côté
le plus énergétique du spectre), moins il est chaud, et plus
sa couleur se rapprochera du rouge. C'est ainsi que l'on peut avoir une
idée de la température superficielle des étoiles au
simple constat de leur couleur. Ajoutons que le rayonnement cosmologique*,
diffusé quelque centaines de milliers d'années après
le big bang, a également un spectre de
corps noir. Son maximum de rayonnement se situe à l'heure actuelle
dans le domaine micro-ondes, ce qui correspond à une température
de 3K.
 Outre celui du rayonnement de corps
noir, les spectres continus sont caractéristiques de plusieurs
sortes de types de rayonnements. On citera le rayonnement synchrotron
et le rayonnement Cerenkov, le rayonnement Compton
et Compton inverse, et le rayonnement free-free.
Chacun des spectres correspondant possède un profil différent,
ce qui permet en général de l'identifier.
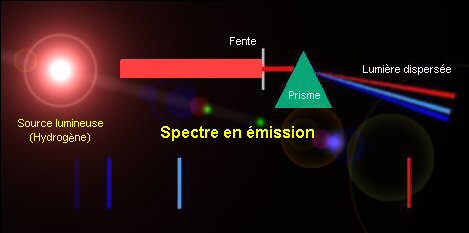
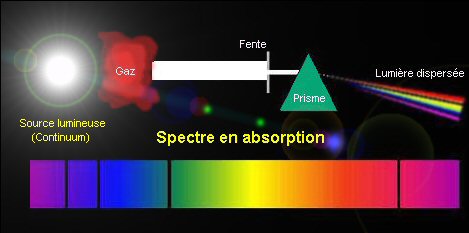
Les spectres de raies Lorsqu'on disperse un rayonnement lumineux pour former un spectre, on constate dans de nombreux cas (notamment lorsqu'il s'agit de rayonnements astronomiques) que des radiations, correspondant à certaines longueurs d'ondes ou fréquences sont plus faible, voire absentes, et que d'autres en revanche sont très intenses. Cela se traduit sur le spectre sous forme de raies sombres (raies en absorption) ou brillantes (raies en émission) respectivement. Les conditions de température et
de pression, ainsi que la présence ou non de champs magnétiques
et électriques influent sur les caractéristiques d'un tel
spectre. Certaines raies peuvent être plus ou moins larges, plus
ou moins floues, elles sont parfois dédoublées. Mais ce qui
le paramètre fondamental est la composition chimique du gaz impliqué.
La succession de ces raies forment des ensembles ou systèmes qui
sont d'abord caractéristiques des éléments
chimiques responsables de l'émission (ou de l'absorption) des
radiations concernées. Et c'est donc seulement secondairement que
l'intensité de ces raies, leur largeur, etc., informent sur les
conditions physiques qui dans lesquelles se trouvent ces éléments.
 Les spectre en
absorption.
 |
|||||||||||||||
Rouages |
L'origine
des raies
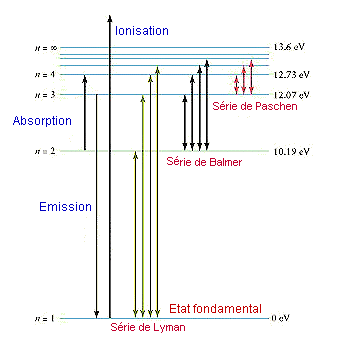
Les raies présentes dans les spectres s'expliquent par le caractère discontinu des phénomènes physiques lorsqu'on les considère à l'échelle microscopique, et plus spécialement à l'échelle des atomes et des molécules. C'est le domaine de la mécanique quantique, fondée sur la notion de quantum. Un quantum correspond à la plus petite valeur que peut prendre grandeur mesurée. Toutes les autres valeurs sont des multiples de ce quantum élémentaire. Par exemple, un quantum d'énergie ne peut prendre que des valeurs qui sont des multiples entiers de E = hn, où h est un terme constant (constante de Planck) et n la fréquence de l'onde qui transporte cette énergie. Il s'ensuit entre autres choses de ces principes quantiques que les atomes ne peuvent stocker ou libérer de l'énergie que sous forme discontinue. Chaque atome possède ainsi, suivant la disposition des électrons qu'il possède, une gamme d'énergie qui lui sont attribuables : ce sont ses niveaux d'énergie. Chaque niveau exprimant un état d'énergie. L'état de plus basse énergie que peut avoir l'enveloppe électronique d'un atome prend le nom d'état fondamental. Lorsqu'un électron absorbe un photon, l'énergie globale de l'atome augmente, la configuration électronique change et l'atome se trouve alors dans un état dit excité. Si l'énergie absorbée est plus importante, l'électron peut même quitter l'atome, ce qui correspond au phénomène d'ionisation. Cependant, les atomes tendent spontanément à revenir à leur état de plus faible énergie (l'état fondamental), soit en se débarrassant de l'énergie emmagasinée, par sa désexcitation (phénomène de fluorescence), soit, s'il y a eu ionisation, en récupérant l'électron qui s'est échappé (recombinaison). L'excitation, l'ionisation ou le retour
à l'état fondamental ne s'effectuent pas par des chemins
uniques. Les configurations énergétiques de l'atome peuvent
correspondre transitoirement à des niveaux d'énergie intermédiaires.
Cela conduit à l'existence à un nombre considérable
(et même en théorie infini) de transitions possibles entre
les différents états. Ce sont ces transitions, qui correspondent
selon les cas à des absorptions ou à des émissions,
qui expliquent l'existence des raies spectrales.
 -
|
| . |
|
|
|
|||||||||||||||||||||||||||||||
|