| . |
|
||||||
|
|
| . |
|
||||||
|
|
| Antoine-Laurent
Lavoisier
a été le fondateur de la chimie Pour l'encourager, on le fit débuter en 1768 à l'Académie des sciences, à l'âge de vingt-cinq ans, avec le titre d'adjoint chimiste. Lalande rapporte qu'il contribua à le faire nommer, pensant « qu'un jeune homme qui avait du savoir, de l'esprit, de l'activité, et que la fortune dispensait d'embrasser une autre profession, serait très utile aux sciences». Lavoisier se trouva ainsi, tout jeune, associé à titre d'auxiliaire provisoire aux travaux de l'Académie. On a de lui une multitude de notes et de rapports sur les sujets les plus divers; mais, pendant cinq ans, il ne se manifeste guère que comme un membre utile, attentif à ses devoirs, un jeune savant d'espérance. En dehors de la science, c'était
un homme doux, prudent, moral et méthodique, avisé, entendant
fort bien les affaires. Dans le même mois où il était
agrégé à l'Académie, il entra dans les fermes
à titre d'adjoint du fermier général Baudon qui lui
céda un tiers de son intérêt dans le bail du sieur
Alaterre sur lequel reposait le privilège des fermiers généraux.
Lavoisier devint fermier titulaire en 1779, et il prit un rôle de
plus en plus important dans l'administration des fermes, la production
du salpêtre, la fabrication des poudres, etc., jusqu'au moment où
l'Assemblée nationale, le 20 mars 1791, résilia le bail des
fermiers généraux et supprima l'institution ( N'oublions pas la direction supérieure
des entrées de la ville de Paris : sur
la proposition de Lavoisier, la ville fut entourée en 1787 d'un
mur d'octroi. L'impopularité de cette mesure est attestée
par un dicton du temps : « Le mur murant Paris, rend Paris murmurant.
» Joignons-y le comité d'agriculture (1785), où Lavoisier
joua un rôle important. Dans un ordre plus général,
Lavoisier s'honora en provoquant en 1786 l'abolition d'un impôt odieux
transmis par le Moyen âge A partir de 1775, époque où
Lavoisier fut nommé régisseur des poudres, il installa son
laboratoire à l'Arsenal, dans un hôtel qui a été
brûlé en 1871, durant les incendies de la Commune
de 1792. Il y avait résidé jusqu'en 1792, époque
où on le dépouilla de ses fonctions. Pendant dix-sept ans,
ce fut le siège d'un travail incessant. Les savants étrangers
de passage en France 
Antoine-Laurent Lavoisier (1743-1794). En 1771, à l'âge de vingt huit ans, Lavoisier épousa la fille de son collègue dans les fermes, Jacques Paulze, directeur de la Compagnie des Indes, ami de l'abbé Raynal et allié du contrôleur général Terray. Mlle Paulze n'avait que quatorze ans. Vive, intelligente, instruite, elle ne tarda pas à s'associer passionnément à l'oeuvre scientifique de son époux. Ardente à propager sa gloire elle traduisit pour lui les travaux des savants anglais, et elle publia même, en 1788, la traduction de l'ouvrage de Kirwan sur le phlogistique, en y joignant une réfutation. Quelques mots sur son rôle académique : Adjoint à l'Académie des sciences en 1768, associé en 1772 pensionnaire en 1778, directeur de l'Académie en 1785, il en parcourut tous les grades, sans cesse mêlé à ses travaux et à ses rapports sur les sujets divers soumis au jugement de l'Académie: on se bornera à citer les aérostats et le magnétisme animal. En 1791, Lavoisier fut trésorier de l'Académie, puis membre de la commission chargée d'établir un système uniforme de poids et mesures il s'agit du système métrique. Au moment où éclata la Révolution française, Lavoisier avait réalisé les rêves de bonheur et de gloire conçus au début de sa carrière. Il était riche, estimé, entouré d'amis, investi de fonctions élevées, regardé comme l'un des premiers savants de la France et du monde, l'honneur de l'Académie des sciences, dont il avait été à son jour le directeur. Son laboratoire de l'Arsenal était le centre de sa vie et celui de la science française; les théories qui en étaient sorties avaient, après dix-sept ans de luttes, transformé la chimie, dont Lavoisier était devenu, d'un accord presque unanime, le nouveau créateur. Tel est le comble d'honneur et de félicité d'où il allait être précipité, dépouillé de ses fonctions, de ses honneurs, de ses biens et conduit au supplice. Résumons cette dernière période
de sa vie. En 1787, il fut nommé membre de l'assemblée provinciale
de l'Orléanais 
Ecriture et signature de Lavoisier. Administrateur de la Caisse d'escompte, il en présenta le compte rendu le 21 novembre 1789 à l'Assemblée nationale; adjoint à la commission des monnaies et au comité de salubrité, nommé commissaire de la Trésorerie en 1791, chargé d'un autre côté de faire des expériences sur l'hygiène des hôpitaux et d'assister à la fonte des canons, il était absorbé par des occupations officielles multipliées. La ferme générale à laquelle il appartenait depuis vingt-deux ans fut supprimée le 20 mars 1791. Après le 10 août 1792, il quitta précipitamment son logement et son laboratoire de l'Arsenal. L'Académie des sciences dont il était le plus illustre représentant ne tarda pas à être entraînée dans la ruine générale des institutions anciennes. Dès la fin du mois de novembre 1792, un décret interdisait à l'Académie des sciences de procéder jusqu'à nouvel ordre à des nominations aux places vacantes. Rien n'honore plus Lavoisier que les efforts persévérants qu'il fit pour sauver l'Académie et, après sa suppression, pour faire au moins poursuivre l'oeuvre scientifique, en invoquant les services qu'elle ne cessait de rendre à la République. La conduite des pouvoirs publics, partagés
entre deux tendances opposées, celle de Lakanal, jeune et enthousiaste
de tous les progrès, et celle de Fourcroy,
prépondérant au comité d'instruction publique et ennemi
acharné de l'Académie, étaient contradictoires. Tandis
que la Convention, le 1er
août 1793, décrétait l'uniformité des poids
et mesures, félicitait l'Académie de ses travaux sur la question
et la chargeait d'en surveiller l'exécution, le 8 août, cette
même Convention ordonnait la suppression de toutes les académies
et sociétés littéraires patentées et dotées
par la nation. Le 10 août 1793, l'Académie tint sa dernière
séance; elle ne se réunit plus désormais.

Lavoisier en costume de fermier général. La personne même de Lavoisier allait
être atteinte. Le 24 novembre, sur la proposition de Bourdon de l'Oise,
la Convention décréta l'arrestation des fermiers généraux.
Ni les services rendus à la nation par Lavoisier ni la gloire de
ses découvertes ne le protégèrent. En vain s'adressa-t-il
au comité de Sûreté générale pour être
autorisé à continuer son concours aux travaux de la commission
des poids et mesures. Le 28, il dut se constituer prisonnier à la
prison de Port-Libre (Port-Royal). Il fut enveloppé dans la proscription
commune. Le plus dangereux ennemi des fermiers généraux était,
comme il arrive d'ordinaire, un de leurs anciens agents, Antoine Dupin,
naguère contrôleur général surnuméraire
des fermiers, envoyé à la Convention
par le département de l'Aisne. Il présenta, le lundi 9 mai
1774 (5 floréal an Il), un long réquisitoire et provoqua
sans discussion le décret qui les envoyait au tribunal révolutionnaire,
c.-à-d. à la mort ( L'arrêt de mort fut prononcé le 19 floréal an II (8 mai 1794) et exécuté le jour même. Lavoisier mourut avec calme et résignation philosophique, comme on mourait alors. Il périssait comme son confrère Condorcet, en ayant l'amertume d'avoir assisté à la ruine de l'Académie, de la culture scientifique et des hautes idées auxquelles il avait consacré son existence. Il était âgé de cinquante ans et huit mois. Le génie de la victime et l'ingratitude des bourreaux augmentaient l'horreur tragique de l'événement. « Il ne leur a fallu qu'un moment », disait le lendemain Lagrange à un ami, « pour faire tomber cette tête, et cent ans peut-être ne suffiront pas pour en reproduire une semblable.-»Quelque douloureuse qu'ait été une telle perte pour la science, la gloire personnelle de Lavoisier n'en a pas souffert. Peut-être au contraire a-t-elle profité de ce qu'y ont ajouté le prestige d'une fin tragique et le sentiment de la pitié. L'oeuvre scientifique
de Lavoisier.
La
découverte de l'oxygène.
En 1767, Cavendish
démontra par des preuves décisives l'existence spéciale
de l'hydrogène. Alors vint Priestley,
qui découvrit en peu d'années, de 1771 à 1774, les
principaux gaz aujourd'hui connus : oxygène, azote, oxydes d'azote,
acides chlorhydrique, sulfureux, ammoniaque, sans en comprendre d'ailleurs
la véritable constitution. Ces découvertes transformaient
complètement l'antique opinion relative à la nature de l'air
: à la conception d'une substance déterminée, unique,
toujours la même, se substituait la notion d'un état général,
l'état gazeux, applicable à une multitude de corps, sinon
à tous. C'est à Lavoisier qu'il était réservé
d'interpréter ces faits accumulés, en les prenant pour point
de départ de ses propres expériences, et d'en déduire
le système général de la chimie moderne. Le nom même
de chimie pneumatique atteste le point de départ de la révolution.
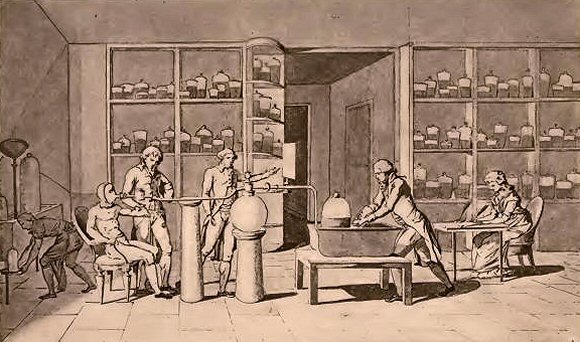
Expériences de Lavoisier sur la respiration humaine. (Homme au repos et, ci-dessous, homme exécutant un travail).  Lavoisier répète d'abord une expérience qui avait été faite avant lui un grand nombre de fois, celle de la calcination de l'étain en présence de l'air; il opère dans un vase hermétiquement clos et il constate aussitôt que le poids total du système ne varie pas, contrairement à l'ancienne opinion de Boyle, qui croyait avoir constaté un accroissement de poids résultant de la fixation de la matière du feu. Cependant l'étain changé en chaux a réellement augmenté de poids, comme Lavoisier le vérifia. C'est donc aux dépens de l'air intérieur, absorbé pendant l'opération, que s'est faite l'augmentation de poids du métal, et elle est précisément égale à la perte de poids éprouvée par cet air. Cette expérience, qui nous paraît si simple aujourd'hui, était en opposition formelle avec les idées régnantes. En effet, les oxydes métalliques et leur formation au moyen des métaux étaient connus de toute antiquité, et l'augmentation de poids qui accompagne leur production avait été constatée par bien des observateurs, depuis la fin du XVIe siècle. Mais, dans l'ignorance où l'on était des propriétés des gaz, on attribuait cette augmentation à la fixation de la matière du feu, qui avait traversé les pores du verre. D'après le système de Stahl, les corps combustibles, tels que le soufre, les huiles, le charbon, renferment un principe particulier, le phlogistique, susceptible de se transformer dans la matière du feu lorsqu'il est soumis à l'influence d'une élévation de température. Cette matière du feu se dissipe avec flamme, chaleur et lumière. Les corps combustibles sont donc formés par cette substance, associée avec une dose plus ou moins considérable de terre. Les métaux échauffés perdent la même substance, en se changeant en chaux métalliques. Les métaux sont donc des corps combustibles, formés par l'union d'une terre ou chaux, avec le principe inflammable. Réciproquement, il suffit d'ajouter à une chaux métallique du phlogistique pour reconstituer le métal primitif ; et l'on y parvient en effet en la chauffant avec un corps combustible, tel que l'huile, le charbon ou le souffre, corps particulièrement riches en phlogistique. Une multitude de phénomènes divers se trouvaient ainsi ramenés à une même conception générale. C'était cette conception que l'expérience de Lavoisier sur l'oxydation de l'étain venait contredire. Il importe de préciser le caractère
véritable de sa découverte, car elle a donné lieu
aux affirmations les plus étranges. Il n'est pas vrai que Lavoisier
ait promulgué le premier cet axiome que : « Rien ne
se perd et rien ne se crée.» Cette doctrine était fort
répandue en science et en philosophie, depuis l'Antiquité Lavoisier n'a pas davantage découvert
l'emploi de la balance, comme on l'a répété souvent
par une erreur non moins singulière. En effet, les chimistes ont
employé de tout temps cet instrument : les alchimistes
gréco-égyptiens, auteurs du papyrus de Leyde Tantôt on voyait les métaux augmenter de poids par la calcination; tantôt, au contraire, les corps combustibles disparaissaient en brûlant, laissant à peine quelques traces de cendre ou terre comme résidu. De là cette opinion, en apparence évidente, que les corps combustibles sont susceptibles de se changer dans la matière ou élément du feu; ou plutôt de régénérer cette matière, qui y était réputée latente. « Le soufre renferme du feu en abondance », disait déjà Pline dans l'Antiquité. Ce même élément du feu semblait au contraire se fixer sur les corps qu'il transformait, tels que les métaux. Le système de Stahl était l'expression scientifique de ces idées, expression admise depuis deux générations, et c'était cette doctrine acceptée de tous que Lavoisier prétendait renverser. Il démontrait en effet que la calcination des métaux résulte de l'union du métal avec une portion de l'air qui l'environne, au lieu d'âtre, comme un l'imaginait alors, le résultat de la séparation d'une portion de phlogistique, précédemment combinée. Les rôles respectifs sont intervertis
entre le métal, qui devient un être simple, et la chaux métallique,
qui est regardée comme composée les bases de la science se
trouvent-par là changées. Non seulement l'air est fixé
dans la formation des chaux métalliques; mais Lavoisier constate
au même moment que l'air est également fixé dans la
formation des acides produits par la combustion du soufre et par celle
du phosphore : d'où résulte un rapprochement inattendu entre
la formation des chaux métalliques et la formation des acides. C'est
une seconde base du nouvel édifice qu'il commençait à
élever.
On savait dès longtemps - le fait est signalé dès le XIIIe siècle - que le mercure chauffé à l'air se change en une matière rouge, appelée précipité per se, comparable aux chaux métalliques, et que cette matière, par la seule action de la chaleur, régénère son métal, sans le contact direct du charbon ou d'aucun corps combustible. Bayen, en février 1774, annonce qu'il a répété cette expérience et constaté qu'il s'y dégage un gaz dont il ne reconnaît pas le caractère particulier et qu'il assimile au gaz observé par Lavoisier dans la réduction des chaux métalliques. Bayen touchait ainsi à la découverte de l'oxygène, mais il ne l'a pas faite. En chauffant ce même précipité per se, au moyen des rayons solaires concentrés par une forte lentille, Priestley obtint le même gaz, le 1er avril 1774, et il sut le caractériser. Il constata d'abord que ce gaz entretenait avec une extrême vivacité la flamme d'une chandelle puis, en mars 1775, il observa que ce gaz entretenait également la respiration et même la rendait plus aisée; ce qui le fit penser aussitôt aux applications médicales de l'oxygène. Les faits étaient exacts; mais Priestley
se trompa dans leur interprétation. En effet, il regarda son nouveau
gaz comme formé par la matière même de l'air privé
de son phlogistique, qu'il aurait cédé au mercure pour le
régénérer à l'état métallique,
et il le désigna sous le nom d'air déphlogistiqué,
terme corrélatif de cet autre nom, air phlogistiqué,
que Priestley donna à l'azote, découvert par lui presque
en même temps. En effet, l'air chauffé avec les métaux
et avec le mercure en particulier n'est pas absorbé en totalité.
Une portion reste, devenue impropre à entretenir la combustion vive
des chandelles, la calcination des métaux, aussi bien que la respiration
des animaux D'après cette manière de voir et ce langage de Priestley, l'air, on le répète, est envisagé comme un être homogène, non composé, mais modifiable en deux sens opposés, par les actions auxquelles il est soumis, c.-à-d. susceptible de perdre ou de gagner du phlogistique, en formant ainsi deux nouveaux gaz qui dériveraient l'un et l'autre de la matière même de l'air atmosphérique. Lavoisier se servit aussitôt des faits découverts par Priestley pour en conclure au contraire que l'air atmosphérique et les gaz qui en dérivent ne sont pas un seul et même élément, plus ou moins chargé de phlogistique, mais un véritable corps composé. Reprenant les mêmes faits, avec plus de détail et de précision, il en tire cette conclusion nette, hardie, et que personne n'avait osé jusque-là mettre en avant : « L'air est un mélange de deux gaz différents l'air vital (qu'il nomma plus tard oxygène) et la moffette ou azote (nom qui semble dû à Guyton de Morveau) : mais le phlogistique n'a rien à voir dans sa composition. »Ce sont ces affirmations qui constituent sa découverte. Non seulement il fait la synthèse de l'air ordinaire, en mélangeant à la moffette l'air vital absorbé dans la calcination du mercure, puis régénéré; mais il montre que le gaz produit par l'oxyde de mercure et le charbon est de l'air fixé, qui prend dès lors le nom d'acide carbonique, air identique au gaz des autres réductions métalliques, et il établit par là un autre fait fondamental, à savoir la composition même de cet air fixé. Ces expériences étaient décisives par le jour qu'elles jetaient sur la combustion, ainsi que sur la constitution des combustibles et des matières végétales. Ainsi l'oxygène est le générateur de l'acide carbonique et le charbon ne contient pas de phlogistique. Cette vérité une fois acquise pour la combustion du charbon, Lavoisier l'étend aussitôt à la combustion du phosphore et du soufre. Il montre que les acides sulfurique et phosphorique résultent de l'union de ces radicaux avec l'oxygène et en représentent les poids réunis. Le phlogistique, réputé jusque-là
la base du soufre et du phosphore, n'a donc aucune part à ces phénomènes.
Ces découvertes jetaient un jour inattendu sur la constitution des
acides, en la reliant avec la composition même de l'air atmosphérique;
l'air vital devenait ainsi le principe acide par excellence. De là
le nom d'oxygène, que Lavoisier ne tarda pas à lui imposer.
Ses opinions à cet égard étaient, nous le savons aujourd'hui,
trop absolues. A peine a-t-il éclairci la nature véritable
des oxydes et des acides, la nature de l'air et celle de l'oxygène,
qu'il montre les applications de ces résultats, tant à la
respiration animale, assimilée à une combustion, qu'à
la théorie plus générale encore de la chaleur.
Les partisans du phlogistique n'avaient pas manqué de se saisir de ces idées; mais, suivant leur usage, en renversant la signification du phénomène : l'air, disaient-ils, en passant par les poumons, enlève à l'organisme l'excès de phlogistique dont il s'est chargé. Lavoisier, guidé par la suite logique de ses recherches sur l'oxydation des métaux et sur la combustion, écarte, comme toujours, la notion du phlogistique; il démontre par des expériences précises que tout s'explique par l'absorption de l'oxygène au sein du poumon et par la production simultanée de l'acide carbonique : c'est l'absorption de l'oxygène qui fait le sang artériel et qui produit la chaleur animale. Lavoisier et Laplace allèrent plus loin : ils en donnèrent la preuve, en enfermant un animal dans leur calorimètre, et en mesurant à la fois l'oxygène que l'animal absorbe, l'acide carbonique qu'il produit, la chaleur qu'il développe. Ces expériences sont le point de départ d'une ère physiologique nouvelle. - 
Frontispice d'un des ouvrages de Lavoisier. Lavoisier, à ce moment, avait déjà résolu le problème plus général de la combustion. Dans toute combustion, il y a dégagement de la matière du feu et de la lumière. Les corps ne peuvent brûler, dit-il, que dans une seule espèce d'air, l'oxygène, la combustion n'ayant lieu ni dans le vide ni dans les autres gaz. Dans toute combustion, il y a disparition d'oxygène, et le corps brûlé augmente de poids, exactement dans la proportion de l'air détruit. Ces faits avaient été expliqués par Stahl, ajoute-t-il, par cette supposition qu'il existerait de la matière du feu, du phlogistique fixé dans les métaux, dans le soufre et dans les corps combustibles; mais c'est là une hypothèse qui n'est pas nécessaire, et tous les faits peuvent s'expliquer d'une façon en quelque sorte inverse, en admettant que la base ou matière réelle de l'air et des gaz en général, celle de l'oxygène en particulier, est combinée avec un fluide subtil, matière commune du feu et de la lumière, lequel dissout la base de l'air et lui communique son élasticité. Le corps qui brûle s'empare de la base de l'air pendant la combustion, ce qui en augmente le poids; tandis que la matière du feu, privée elle-même de toute pesanteur, s'échappe avec flamme, chaleur et lumière. Ces phénomènes, qui sont extrêmement lents et difficiles à saisir dans la calcination des métaux, sont, au contraire, presque instantanés dans la combustion du soufre, du phosphore et du charbon. Ainsi Lavoisier établissait une séparation radicale entre la matière pesante, constitutive des métaux, des corps combustibles et de l'oxygène, matière dont la balance constatait l'invariabilité avant, pendant et après la combustion, d'une part; et de l'autre, le fluide igné, dont l'introduction par une source extérieure, ou le départ pendant la combustion même, ne concourait ni à augmenter le poids des corps, ni à le diminuer : contrairement à ce que supposaient tour à tour, et suivant les cas, les partisans du phlogistique. Il est vrai que le charbon, le soufre, le phosphore enflammés en vase clos par une lentille brûlent avec flamme et lumière; mais il faut pour cela la présence de l'oxygène; et la chaleur ainsi produite se dissipe au dehors, sans que le poids du vase ou de son contenu éprouve le moindre changement. Boerhaave et d'autres avaient déjà constaté que la chaleur accumulée dans les corps sous une forme sensible, dans une barre de métal rougi par exemple, n'en change pas le poids : mais il s'agissait de phénomènes purement physiques, et toute la chimie reposait alors sur une hypothèse opposée. Le même Boerhaave écrivait en 1754, quelques années avant Lavoisier : « La chimie nous a fait voir qu'elle sait réduire le feu, qu'elle peut le fixer, le peser, l'unir aux corps, l'en chasser. »La distinction absolue entre la matière pondérable et les fluides éthérés soustraits à l'action de la pesanteur, dans l'ordre chimique aussi bien que dans l'ordre physique, devint dès lors fondamentale en philosophie naturelle : c'est Lavoisier qui l'a clairement aperçue. En partant de ces idées, il a jeté avec Laplace, dans un mémoire justement célèbre, les premières bases de la thermochimie. La
composition de l'eau.
«L'eau paraît une substance inaltérable et indestructible, du moins jusqu'à présent; il n'y a aucune expérience connue, de laquelle on puisse conclure que l'eau peut être décomposée. »L'eau continuait donc à être regardée, conformément à la tradition de tous les siècles et de toutes les écoles, comme un élément. La formation de l'air inflammable, c.-à-d. de notre hydrogène, demeurait inexplicable. L'hydrogène apparaît, en effet, dès qu'on traite les métaux, tels que le fer ou le zinc, par la plupart des acides. Il apparaît également lorsque le fer est attaqué par la vapeur d'eau, et même par l'eau liquide. Si donc l'eau est un élément indécomposable, il semble nécessaire d'admettre que l'hydrogène résulte de la décomposition du métal, une chaux métallique étant formée simultanément : soit que cette chaux demeure libre, comme dans la réaction directe du fer sur l'eau, ou qu'elle se combine à l'acide pour engendrer un sel, comme dans la réaction des acides. Nous retournons ainsi à la théorie du phlogistique. Aussi, à la suite de la découverte de l'hydrogène, la plupart des chimistes regardèrent-ils ce gaz comme représentant le principe combustible par excellence, le phlogistique lui-même, ou plutôt comme l'une des formes et la plus pure de cet être subtil que l'on supposait contenu dans les métaux. Telle était au début l'opinion de Cavendish qui avait découvert l'hydrogène. Il ne tarda pas à constater que la combustion de l'air inflammable ne donne pas naissance à autre chose qu'à de l'eau : c'est le point de fait capital dans la découverte. Cependant Cavendish n'en donna pas tout d'abord la véritable interprétation et demeura flottant à cet égard. Lavoisier, Priestley, Monge concoururent ensuite à l'étude progressive du fait, dont la filiation a donné lieu à de longues discussions. Mais Lavoisier eut seul la claire vue de la théorie, théorie que ses travaux antérieurs sur le rôle de l'oxygène dans la formation des oxydes et des acides devaient faire pressentir à tous les chimistes éclairés de l'époque : il osa le premier proclamer clairement et publiquement la composition de l'eau, vérité qui est devenue l'une des pierres angulaires de la science chimique. S'il l'a fait tout d'abord et hardiment, alors que les autres savants hésitaient encore sur l'interprétation des faits, c'est parce que son esprit était libre des entraves de cette hypothèse du phlogistique qui troublait à la fois le langage et la pensée de ses contemporains. Il en tira des conséquences qui donnèrent à sa doctrine une extension plus grande. Les ordres de phénomènes qu'il aborda aussitôt pour les expliquer sont la formation de l'eau dans la réduction des oxydes métalliques par l'hydrogène, ainsi que dans la combustion des matières organiques. Si l'on ajoute que, dans cette combustion, il se forme de l'acide carbonique, on comprendra comment l'analyse élémentaire des matières organiques fut ainsi démontrée pour la première fois et la nature de la fermentation alcoolique éclaircie. Lavoisier, d'autre part, complétant la synthèse par l'analyse, démontra la décomposition de l'eau par les métaux, soit seuls, soit avec le concours des acides : phénomènes demeurés jusque-là obscurs et invoqués comme l'une des preuves les plus certaines à l'appui de leur théorie par les partisans du phlogistique. Une
nouvelle chimie.
Les mathématiciens et les physiciens
de l'Académie, qui n'avaient cessé
de soutenir Lavoisier par leurs encouragements, se déclarèrent
tout d'abord. Berthollet se rangea aux idées
nouvelles, par une déclaration publique, en 1785; Guyton
de Morveau constata sa conversion en 1786, à la fin du
premier volume du Dictionnaire de chimie de l'Encyclopédie
méthodique 
Lavoisier et son épouse, Marie-Anne Paulze, par David (1788). Voilà comment il a réussi à faire sortir la chimie des idées vagues, des systèmes mystiques où elle s'était complu pendant tant de siècles, et à définir l'origine et le terme des transformations. Ce terme et cette origine résident en effet dans l'invariabilité de poids de la matière pondérable; pas seulement en général, mais pour chaque corps simple en particulier. De là résulte l'existence d'une équation du poids des corps simples dans les métamorphoses chimiques, équation sur laquelle reposent désormais analyses et interprétations. Cette équation est aussi l'oeuvre de Lavoisier, qui l'a formulée en 1785, dans son mémoire sur la dissolution des métaux dans les acides, en l'accompagnant même d'une représentation symbolique, première ébauche de nos formules actuelles. Ainsi les corps simples et l'analyse devinrent le but extrême des efforts de la chimie. Lavoisier revient sans cesse sur ce point de vue : « La chimie, dit-il, en soumettant à des expériences les divers corps de la nature, a pour objet de les décomposer et de se mettre en état d'examiner séparément les différentes substances qui entrent dans leur composition. »La chimie était pour lui, et par excellence, la science de l'analyse, dont la synthèse était regardée comme une simple contre-épreuve. C'est ainsi qu'il dit encore : « La chimie marche donc vers son but et vers sa perfection en divisant, subdivisant et resubdivisant encore, et nous ignorons quel sera le terme de ses succès. »La notion purement empirique des corps simples, étant ainsi fixée, devint la base d'une nomenclature nouvelle, destinée à remplacer par des noms rationnels, fondés sur la composition des corps, les vieux noms empiriques et traditionnels. Ce fut Guyton de Morveau qui commença l'entreprise en 1782 et qui, pour l'accomplir, s'adjoignit un peu plus tard les principaux chimistes français. Elle reposait sur la distinction des composés binaires et spécialement des composés oxygénés en oxydes et acides qui, s'opposant les uns aux autres suivant un mode dualistique, donnent naissance aux composés ternaires, spécialement aux composés salins. Cette nomenclature fut accueillie d'abord
avec enthousiasme et identifiée, par suite d'une illusion singulière
due aux idées de Condillac, avec la
science elle-même. La langue nouvelle fut présentée
en détail dans le traité de Lavoisier, le premier ouvrage
méthodique écrit dans le nouveau système, et elle
fut aussitôt adoptée dans l'Europe 
Ex-libris de Lavoisier.
|
| . |
|
|
|
|||||||||||||||||||||||||||||||
|