| N |
L'azote
[symbole : N] est un élément
chimique non-métallique (groupe
15 du tableau périodique), présent dans l'air que nous
respirons sous forme de molécules diatomiques N2,
et qui représente environ 78% du volume total de l'atmosphère
terrestre. C'est un gaz à température ambiante, incolore,
inodore et insipide. Impliqué dans l'un des principaux cycles biogéochimiques
de la biosphère, il est essentiel pour
toutes les formes de vie (3% des atomes du corps humain, par exemple, sont
des atomes d'azote).
Très peu soluble
dans l'eau et les solvants organiques, l'azote est également
peu réactif dans des conditions normales et ne se combine pas facilement
avec d'autres éléments ou composés. C'est un mauvais
conducteur thermique et un isolant électrique. En raison de ses
propriétés physique et chimiques, l'azote est utilisé
dans l'agriculture, la médecine ou l'industrie, où il intervient
dans une grande variété d'applications, comme la production
d'ammoniac, d'acide nitrique et d'engrais.
.
Numéro
atomique
Masse
atomique
Point
d'ébullition (°C)*
Point
de fusion (°C)
Masse
volumique (g/cm3)
Structure
électronique
Degrés
d'oxydation |
7
14,0067
-195,8*
-209,9
0,81*
1s22s22p3
3,5,4,
2 |
|
La nucléosynthèse
de l'azote.
L'azote est le septième
élément le plus abondant dans l'univers. Tout les atomes
d'azote qui existent ont été produits au cours de réactions
nucléaires diverses par les étoiles,
soit dans leur coeur au cours de leur existence, soit au cours de l'explosion
finale des plus massives d'entre elles.
Dans les étoiles
de la séquence principale,
au moins 30% plus massives que le Soleil, l'azote
est produit au terme du processus dit triple alpha, dans lequel trois noyaux
d'hélium sont fusionnés pour former du carbone,
et qui peut aboutir ensuite à la production d'azote par une série
de réactions nucléaires supplémentaires.
Enfin, notons, que
lorsque des étoiles massives manquent de carburant et s'effondrent
sur elles-mêmes, le rebond de leur enveloppe sur leur noyau provoque
une explosion violente appelée supernova. L'énergie
dégagée est en mesure de provoque la nucléosynthèse
de nouveaux noyaux atomes, parmi lesquels firgure aussi l'azote.
Les composés
de l'azote.
La stabilité
et la très faible réactivité de l'azote tient à
ce qu'il se présent sous la forme d'une molécule
dans laquelle les deux atomes sont reliés une très solide
triple liaison covalente. Lorsqu'il est exposé à des températures
élevées, à des pressions ou à des étincelles
électriques, l'azote, avec ses cinq électrons de valence,
peut
toutefois réagir avec d'autres éléments en se liant
à eux le plus souvent par des liaisons covalentes
L'azote réagit avec l'oxygène
pour former des oxydes d'azote. Il peut aussi réagir avec certains
métaux
, tels que le lithium, le calcium, le bore et
le magnésium, pour former des nitrures. Avec les halogènes,
l'azote formera des halogénures d'azote, tels que le trifluorure
d'azote. Au final, on pourra rencontrer l'azote en combinaison dans des
molécules parfois très simples, à commencer par celles
de l'azote gazeux (N2), comme
dans des composés organiques complexes, tels les acides
aminés et les acides nucléiques.
L'ammoniac.
Couramment utilisé
dans les engrais, ainsi que dans la production d'acide nitrique, d'explosifs
et de produits de nettoyage, l'ammoniac (NH3) est
un gaz incolore avec une forte odeur piquante, moins dense que l'air. C'est
un agent réducteur et le seul gaz commun à former une solution
alcaline dans l'eau, la solution d'ammoniaque (NH4OH)
ou hydroxyde d'ammonium. L'ammoniac brûle dans l'oxygène pur
pour donner de l'azote et de l'eau, et réagit avec le chlore
pour donner du chlorure d'ammonium.
Le
chlorure d'ammonium.
Le chlorure d'ammonium
(NH4Cl) ou sel ammoniac est solide cristallin blanc,
soluble dans l'eau. Chauffé, il se sublime et se dissocie. Il est
utilisé dans les piles sèches qui font fonctionner de nombreux
appareils électriques.
Les
oxydes d'azote.
L'azote peut réagir
avec l'oxygène pour former des oxydes
d'azote, qui, pour certains, peuvent contribuer à la pollution atmosphérique.
• Le
protoxyde d'azote (N2O) est un gaz incolore avec
une odeur légèrement sucrée connu sous le nom de "gaz
hilarant" en raison de son utilisation comme anesthésique et drogue
récréative. C'est un gaz à effet de serre dont l'émission
est en lien avec l'utilisation d'engrais azotés minéraux
et la gestion des déjections animales (phénomènes
de nitrification / dénitrification).
• Le monoxyde
d'azode ou oxyde nitrique (NO) est un gaz incolore insoluble
dans l'eau, avec une odeur légèrement sucrée, utilisé
dans la production d'acide nitrique et comme molécule de signalisation
dans le corps, régulant le flux sanguin et la fonction immunitaire.
Il réagit avec l'oxygène pour former du dioxyde d'azote et
favorise également la combustion des éléments réactifs.
• Le dioxyde d'azote
(NO2) est un gaz brun très foncé avec
une odeur d'étouffement, utilisé comme agent oxydant. C'est
un composé covalent. Il entretient la combustion et se dissout dans
l'eau pour donner un mélange d'acide nitrique
et d'acide nitreux (HNO2). C'est un polluant atmosphérique
toxique qui est produit par la combustion de combustibles fossiles et qui
contribue grandement au smog et aux pluies acides. Il peut aussi causer
des problèmes respiratoires
L'acide
nitrique.
L'acide nitrique
(HNO3) ou acide nitrique (V) est un liquide
jaune très clair (presque incolore), huileux, soluble dans l'eau,
et hautement corrosif. C'est un composé covalent contenant de l'azote
à l'état d'oxydation +5. L'acide nitrique concentré
est un mélange de 70 % d'acide nitrique et de 30 % d'eau. C'est
un puissant oxydant. L'acide nitrique dilué est une solution d'acide
nitrique à 10% dans l'eau. Il réagit avec les bases pour
donner des sels de nitrate et de l'eau. L'acide nitrique est utilisé
pour fabriquer des engrais et des explosifs.
L'urée.
L'urée (NH2CONH2)
est un composé cristallin blanc utilisé comme engrais et
dans la production de plastiques, de résines et d'adhésifs.
Les
nitrates.
Les nitrates, qui
sont des sels de l'acide nitrique, sont des composés ioniques qui
incluent l'anion nitrate (NO3-)
et un cation métallique. L'azote dans un ion nitrate a un état
d'oxydation de +5. Les nitrates sont tous solubles dans l'eau
et la plupart dégagent du dioxyde d'azote et de l'oxygène
par chauffage (à l'exception des nitrates de sodium ou salpêtre
(NaNO3), de potassium (KNO3)
et d'ammonium). Le nitrate d'ammonium (NH4NO3)
est un solide cristallin blanc soluble dans l'eau formé lorsqu'une
solution d'ammoniac réagit avec de l'acide nitrique dilué.
Il dégage de l'oxyde de diazote lorsqu'il est chauffé. On
trouve les nitrates couramment dans les
engrais et les aliments, comme les légumes et la charcuterie.
Les
nitrites.
L'anion nitrite
(NO2-) forme avec un cation
métallique les nitrites ou composés de nitrite(III), qui
sont généralement des agents réducteurs. Citons :
le nitrite de sodium NaNO2;
le nitrite de potassium KNO2;
le nitrite de calcium Ca(NO2)2.
Ces composés ioniques solides sont présent dans les charcuteries
et peuvent former des composés cancérigènes lorsqu'il
est cuit à haute température.
Les
cyanures et les nitriles.
L'ion cyanure
(CN-), ou un atome d'azote est relié à un atome
de carbone par une liaison triple (C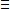 N-)
donne son nom aux cyanures (exemples : cyanure de portassium de formule
brute KCN, cyanure de de sodium (NaCN), cyanure d'argent (AgCN)).
Ce sont des composés hautement toxiques. Ils sont utilisé
dans la production de plastiques, la galvanoplastie et l'exploitation minière.
Les composés comportant le groupement -C N-)
donne son nom aux cyanures (exemples : cyanure de portassium de formule
brute KCN, cyanure de de sodium (NaCN), cyanure d'argent (AgCN)).
Ce sont des composés hautement toxiques. Ils sont utilisé
dans la production de plastiques, la galvanoplastie et l'exploitation minière.
Les composés comportant le groupement -C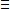 N
sont appelés nitriles. Certains d'entre eux peuvent aussi être
toxiques. N
sont appelés nitriles. Certains d'entre eux peuvent aussi être
toxiques.
Le
trifluorure d'azote.
Le trifluorure d'azote
(NF3) est un gaz incolore utilisé dans la production
de composants électroniques et de cellules photo-voltaïques.
Le
sulfate d'ammonium.
Le sulfate d'ammonium
((NH4)2SO4) est un solide cristallin
blanc soluble dans l'eau produit par la réaction de l'ammoniac et
de l'acide sulfurique. Il est utilisé comme engrais. |
|